2023年3月31日
當地時間2023年3月18日,傳奇生物(NASDAQ: LEGN)在美國新澤西州薩默塞特公布了2022全年第四季度未審計的財務業績。
“2022年是傳奇生物具有重要里程碑意義的一年,以CARVYKTI?在美國、歐洲和日本獲得監管批準為標志。除了推出我們的第一個商業產品外,我們還推進了cilta-cel的臨床開發計劃,并獲得了FDA對其兩種針對實體瘤的研究性新藥申請的批準。此外至關重要的是,我們擴大了我們的商業基礎設施和制造能力,以支持未來的增長”。傳奇生物首席執行官黃穎補充道:“我們整個公司的團隊在忙碌的一年中表現出色。展望未來,我們將繼續專注于擴大制造規模和推進臨床計劃,以將CARVYKTI?提供給更多有資格的患者。”
2022年下半年亮點及近期活動
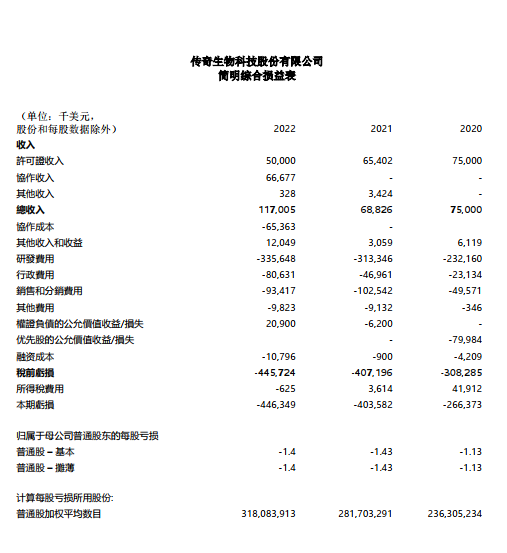
截至2022年12月31日止年度的財務業績
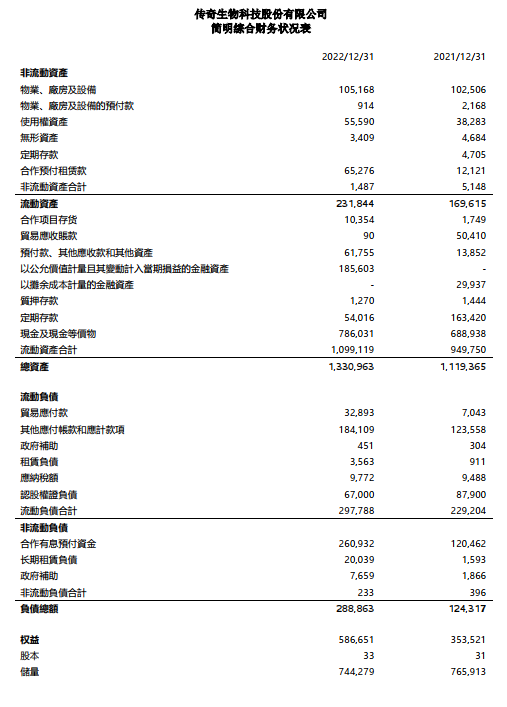
現金和現金等價物、定期存款和短期投資
截至2022年12月31日,傳奇生物擁有約10億美元現金及現金等價物、定期存款和短期投資。
收入
截至2022年12月31日止年度的收入為1.17億美元,而截至2021年12月31日止年度的收入為6,880萬美元。增加4,820萬美元是由于CARVYKTI ?在美國商業化上市的產品銷售,及傳奇生物的與Janssen Biotech, Inc.的合作協議(“Janssen 協議”)。
研發費用
截至2022年12月31日止年度的研發費用為3.356億美元,而截至2021年12月31日止年度的研發費用為3.133億美元。增加2,230萬美元的主要原因是繼續投資cilta-cel用于早期療法,并增加在傳奇生物的支出。傳奇提交了兩項研究性新藥申請,并在截至2022年12月31日止年度開始為在美國進行的第一階段臨床開發做準備。
行政費用
截至2022年12月31日止年度的行政費用為8,060萬美元,而截至2021年12月31日止年度的管理費用為4,700萬美元。增加3,370萬美元主要是由于某些信息技術服務在從金斯瑞生物科技股份有限公司分離的最后階段,需要加強網絡安全和隱私,以及支持制造設施所需的信息技術基礎設施建設。
銷售和分銷費用
截至2022年12月31日止年度的銷售和分銷費用為9,340萬美元,而截至2021年12月31日止年度的銷售和分銷費用為1.025億美元。增加910萬美元的主要原因是與CARVYKTI?商業化相關的成本。
其他收入和收益
截至2022年12月31日止年度的其他收入和收益為1200萬美元,而截至2021年12月31日止年度為310萬美元。增加890萬美元主要是由于利息收入、政府撥款和金融資產的公允價值收益增加。
其他費用
截至2022年12月31日止年度的其他費用為980萬美元,而截至2021年12月31日止年度的其他費用為910萬美元。增加的主要原因是當年的外匯匯兌損失。
融資成本
截至2022年12月31日止年度的財務成本為1,080萬美元,而截至2021年12月31日止年度則為90萬美元。增加的主要原因是預付資金的利息,這是楊森根據《楊森協議》提供的有息借款,由本金和該本金的適用利息構成。傳奇生物選擇根據楊森協議的條款,于2022年12月31日增加1.303億美元借款。
認股權證的公允價值變動收益
截至2022年12月31日止年度,認股權證負債的公允價值收益為2,090萬美元,原因是傳奇生物科技于2021年5月通過私募交易向機構投資者發行的初始公允價值為81.7美元的認股權證在發行日的公允價值變動。截至2022年12月31日,該認股權證被評估為一項金融負債,其公允價值為6,700萬美元。
本期虧損
截至2022年12月31日止年度凈虧損為4.463億美元,或每股1.40美元,而截至2021年12月31日止年度,凈虧損為4.036億美元,或每股1.43美元。

關于傳奇生物
傳奇生物(NASDAQ:LEGN)成立于2014年,是一家集腫瘤免疫細胞療法研發、臨床、生產及商業化開發于一體的跨國生物制藥公司,位列全球免疫細胞療法領域第一方陣,全球員工總數已逾1000人。目前通過與楊森的合作,首款產品CARVYKTI?(西達基奧侖賽,Cilta-cel)已于2022年獲得美國食品藥品監督管理局(FDA)、日本厚生勞動省(MHLW)批準上市,并獲得歐盟委員會(EC)附條件上市許可,有望解決多發性骨髓瘤治療的世界級難題。2022年底,國家藥品監督管理局已正式受理西達基奧侖賽的新藥上市申請(NDA),并于2023年1月納入優先審評程序。此外,公司還有多款在研細胞療法,用于血液瘤、實體瘤及其它疑難疾病的治療。公司先后榮獲“中國生物醫藥產業鏈創新風云榜鯤鵬獎”、“中國醫藥創新企業100強”、“南京市引才用才示范企業金梧桐獎”、“《麻省科技評論》50家聰明公司”、“最具影響力創新療法企業TOP20”、“中國醫藥高質量發展成果企業”等榮譽。更多信息請訪問:www.www.yamasatw.com
傳奇生物公布2025年第一季度業績及近期亮點
2025年5月13日
傳奇生物公布2024年第四季度和全年業績及近期亮點
2025年3月11日
2024 ASH | 與標準治療相比,CARVYKTI? 顯著提高了復發或難治性多發性?..
2024年12月10日
傳奇生物公布2024年第三季度業績及近期亮點
2024年11月12日
